| 당뇨병과 비만에서의 동물 모델 실험 |
|
이대호
제주대학교 의학전문대학원 내과 |
|
동물모델을 이용하여 비만증 및 당뇨병의 연구에 괄목할 만한 발전이 이루어져 왔으며 현재도 여전히 전통적인 비만증 및 당뇨병 모델들이 연구에 꾸준히 이용되고 여기에 더하여 최근에는 유전자 결손 혹은 과발현 모델을 연구자가 직접 개발하여 연구에 이용할 수 있는 단계까지 이르렀다. 하지만 동물모델이 반드시 인체의 대사과정이나 인간의 질환을 완벽하게 반영하지 못한 경우도 많이 있으므로 주의가 필요하다. 따라서 연구자는 적절한 동물모델을 실험 목적에 맞게 선택하고 그 동물모델의 특성을 정확히 파악하여 실험을 계획해야 하며 연구결과를 해석하는데 있어서도 충분한 문헌검토와 경험자들의 자문을 구하여 인간의 질병과 동물실험 모델에서 나온 결과를 합리적으로 연결시켜야 한다.
동물실험 계획 시 주의사항 동물실험을 시행하기 전에 먼저 지켜야 할 규정을 검토해야 하며 해당기관의 위원회의 승인을 거쳐야 한다. 해외의 사례를 들면 미국에서는 많은 기관에서 실험동물의 관리에 대해서 규정하고 있으므로 해외 연수 중에도 특히 주의해서 오리엔테이션 교육을 받아야 하며 규정을 어긴 경우 심지어 해당 연구책임자의 동물실이 폐쇄될 수도 있음을 알아야 한다. 아래의 예는 대표적인 예를 열거한 것이다. 또한 실험 쥐나 생쥐의 일반적인 특성이 다른 경우가 있기 때문에 알아두는 것도 도움이 된다. 통상 생쥐는 표준 cage에 4마리 이상을 넣지 않는 것이 좋으며 흔히 사용하는 C57BL/6J mice의 경우 수컷은 성질이 거칠어서 생후에 같이 자라지 않은 cage에서 함부로 섞어서 사육하는 경우 심한 fighting에 의한 손상을 서로에게 주어서 심한 스트레스를 야기하고 실험에 영향을 주는 경우가 있으므로 주의를 요한다. 다른 포유동물들처럼 쥐나 생쥐(e.g., C57BL/6J)들에서도 위계질서가 있고 행동 양식이 있으므로 cage마다 실험동물의 수가 다른 경우는 행동양식이나 식이섭취 등도 달라질 수 있으므로 cage 당 실험동물은 동수를 사육해야 한다. 통상 쥐나 생쥐는 야간에 특히 어둠이 시작될 때와 새벽에 하루 총 섭취량의 3/4을 섭취하므로 식이계획을 세울 때 참고 할 필요가 있으며 overnight fasting은 심한 스트레스임을 인식하여 너무 자주 금식시키는 실험은 피해야 하며 꼭 필요한 경우 통상 1주 이상의 간격을 두고 overnight fasting을 시키는 것이 좋다. 대사적 실험을 할 때는 금식기간에 깔짚에 남아 있는 사료를 먹기 때문에 금식시키는 경우 깔짚까지 교체하는 것이 좋고 실험동물에 따라서 (특히 db/db mice의 경우) 혈당을 측정할 때 미리 handling을 하여 스트레스에 적응하도록 하고 실험 당일도 매우 조용한 환경에서 시행해야 하며 oGTT나 insulin tolerance test시에 기저치를 측정할 때 스트레스에 따라서 혈당치가 심한 차이를 보이므로 수분내지 수십 분의 간격을 두고 두 번 측정하는 것이 좋다. 여기에 더해서 추가로 일반적인 주의사항은 참고문헌 특히 Wang CY and Liao JK (1)의 프로토콜을 따를 것을 권한다. 실험 동물에 대한 최대 약물투여 양 (volume)은 투여 경로에 따라 다르며 채혈 방법 역시 여러 가지 방법이 있으며 각각의 장단점과 가능한 채혈량 및 주의사항을 알아두면 크게 도움이 된다 (2). The European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECVAM)에서 권고하는 기준을 소개하고자 한다 (2). 특히 표 1에서 제시한 투여 최대 용량을 초과하는 경우는 실험동물의 welfare 혹은 실험 결과에 이상을 초래할 수 있다. 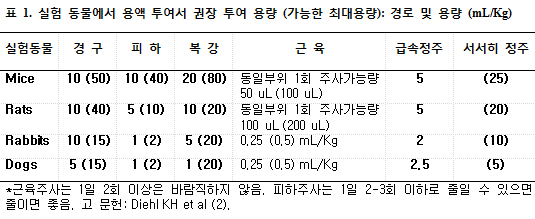
실험동물에서 채혈할 때는 그 동물의 전체 예상 혈액량을 알면 크게 도움이 될 것 이다 (2). 생쥐의 경우 평균 혈량은 72 mL/Kg (range 63-80)이며 쥐는 64 mL/Kg (range 58-70), 토끼는 56 mL/Kg (range 44-70), 개는 85 mL/Kg (range 79-90) 정도 이다 (2). 통상 혈액량의 15% 이상에 해당하는 량을 한꺼번에 채혈하는 것은 권장되지 않으며 또한 회복하는데도 4주 정도 걸린다는 것을 알아야 한다. 보통 혈액량의 7.5%, 10%, 15%에 해당하는 양을 한꺼번에 채혈하는 경우 회복기간은 각각 1주, 2주, 4주 정도 걸린다 (2). 하루에 여러 번 나누어서 채혈할 수 있으며 이러한 경우 혈액량의 7.5%, 10-15%, 그리고 20%에 해당하는 양을 한꺼번에 채혈하는 경우 회복기간은 각각 1주, 2주, 3주 정도 걸린다. 따라서 30g 생쥐의 경우 전체 혈량의 10% 정도인 혈액인 대략 200 uL를 채혈하면 2주 정도 후에 재 채혈이 가능하다는 얘기이다 (표 2). 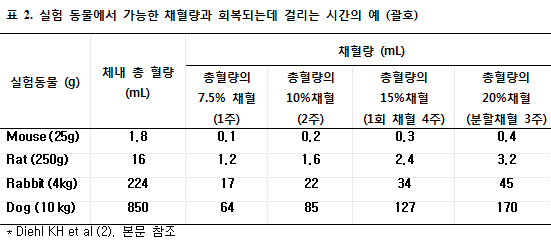
생쥐와 쥐의 경우 마취 없이 채혈이 가능한 부위로서 lateral tail vein을 쉽게 이용할 수 있으며 생쥐의 경우 100-200 uL, 쥐의 경우 최대 2 CC까지 채혈이 가능하다. 꼬리 정맥의 확장을 위해서 37-39도 정도의 heat box에서 수분간 (주의: 통상 5분 이내이며 쥐가 튀어 달아날 수 있으므로 세심하게 관찰 필요하며 심하게 튀거나 irritable해지면 바로 heat box에서 꺼내야 함) 유치시킨 후 채혈해야 한다. 비만증 및 당뇨병 연구에 흔히 사용하는 동물모델 인간의 제 2형 당뇨병과 유사한 동물 모델들은 다양한 유전적, 실험실적, 그리고 영양학 적인 원인을 가지고서 여러 가지 종(species)이 존재한다. 우선 고려사항 중에 하나는 췌장 베타세포의 기능의 유지 정도에 따라서 비교적 잘 유지 되는 모델과 질병이 진행됨에 따라 인간의 제 2형 당뇨병 환자와 비슷하게 베타세포 기능이 점차 감소되는 모델이 있다. 유지되는 모델의 대표적인 예는 심한 고인슐린혈증과 비교적 경도의 고혈당을 보이며 베타세포의 인슐린 분비능을 유지하는 Zucker fatty rats (ZFR), ob/ob (obese), KK mouse, corpulent (cp) rat group 을 들 수 있다. ‘Brittle or labile’ pancreatic beta cells 을 가진 모델은 결국 베타세포의 degranulation, apoptosis 등이 진행되어 심한 고혈당 상태에 이르고 지방조직감소와 체중감소, 케톤산증이 진행될 수 있고 생명유지를 위해 인슐린 투여가 필요할 수 있다; db/db (diabetic) mouse, Zucker diabetic fatty (ZDF) rat, sand rat (Psammomys obesus), obese rhesus monkeys (3). 극단적인 렙틴 결핍 혹은 고도의 비만증을 동반하지 않은 제 2형 당뇨병 모델을 이용한 실험을 하는 경우는 다른 모델이 필요하다; GK (Goto-Kakizaki) rats, Akita mouse (3). 여러 모델들 중에서 비만증과 당뇨병을 동반하는 동물 모델은 아래와 같이 요약할 수 있다 (3). Spontaneous or genetically derived diabetic animals : ob/ob mouse, db/db mouse : Kuo Kondo (KK) mouse, yellow KK obese (KK/Ay ) mouse, New Zealand obese (NZO) mouse, NONcNZO10 mouse, Tsumara Suzuki obese diabetes (TSOD) mouse, M16 mouse, Zucker fatty rat, Zucker diabetic fatty (ZDF) rat, spontaneously hypertensive rat/NIH-corpulent (SHR/N-cp) rat, James C Russel (JCR)/LA-cp rat, OLETF rat, Obese rhesus monkey Diet/nutrition induced: Sand rat , diabetic animals C57/BL 6J mouse, Spiny mouse Chemically induced: gold thioglucose-treated obese mice 또한 동물 모델에 따라 한 개의 유전자 이상 (e.g., ob/ob, db/db mice)에 의해서 당뇨병이 발생하는 경우와 당뇨병이 없지만 몇 세대 동안 반복적인 교배에 의해서 특정 유전자라기 보다는 여러 유전자와 환경이 상호작용을 하여 비만증이나 당뇨병이 발생하는 모델이 있다; Tsumara Suzuki Obese Diabetes (TSOD) mouse, Kuo Kondo (KK) mouse, New Zealand obese (NZO) mouse (3). 모든 모델을 소개하는 것 보다 흔히 사용하는 동물모델들을 먼저 리뷰하고자 하며 이러한 동물모델들을 이용하여 실험계획을 세울 때에는 같은 이름의 동물모델이라도 background에 따라서 알려진 특성과 실제 데이터가 달라서 혼돈을 일으킬 수 있다는 것을 먼저 알고 모델명이나 background를 반드시 확인해야 하며 구입처도 일정하고 대조군 역시 같은 구입처와 배경에서 유래한 동물을 이용해야 한다. 흔히 사용하는 동물들도 비만증, 인슐린혈증, 고혈당까지 진행하는 단계가 달라서 실험하는 목적에 따라서 그 특성을 이용할 필요가 있다. 아래 그림은 이러한 단계별로 동물모델들의 특성을 정리 요약한 그림이다. 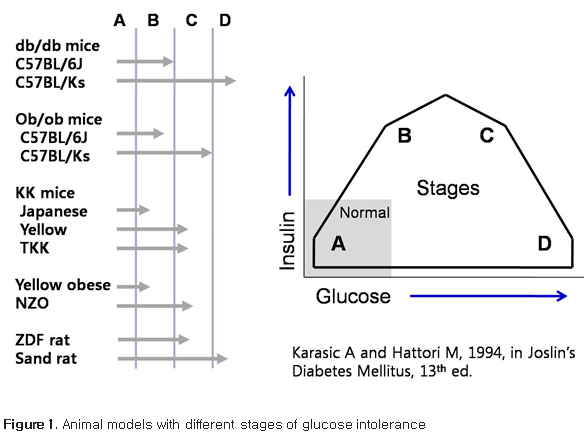 Figure 1. Animal models with different stages of glucose intolerance ob/ob mice Chromosome 6번의 렙틴 유전자에 열성 돌연변이 발생에 의해서 비만증, 고인슐린혈증, 고혈당을 특징으로 하는 모델로서 1949년 Jackon Laboratory의 V strain 중 몇 마리가 어렸을 때부터 비만을 보이다가 결국 고도비만 (~90g)까지 가는 것을 발견하였고 교배를 통하여 유지하면서 이 고도비만을 일으키는 유전자 이상이 C57BL/6J mice와 C57BL/KsJ mice strain에 transfer 되었으며 strain 차이가 C57BL/KsJ mice 배경에서 유전자 이상이 발현되는 경우는 베타세포의 손상이 진행되어 심한 고혈당에 이르는 특징이 더 현저하고 C57BL/6J mice 배경에서는 고인슐린혈증과 경도의 고혈당을 보이는 것으로 strain 차이가 나타나는 것으로 밝혀졌으며 통상 ob/ob mice라고 하는 경우는 대개 C57BL/6J mice background을 말한다. 하지만 원래의 Jackson Laboratory에서 유지되었던 것과는 다른 inbred backround를 가진 ob/ob mice가 전 세계적으로 여러 군데에서 유지되고 있으므로 이러한 유전적 배경에 따라서 고혈당의 정도나 대사적 이상의 정도가 가끔씩 크게 다르게 보고되는 경우가 있음을 알고 이 동물 모델을 이용하는 것이 혼돈을 줄일 수 있다 (4). 앞서 말했듯이 C57BL/6J mice background의 ob/ob mice에서는 비만증과 함께 고인슐린혈증이 있지만 경도의 고혈당을 특징으로 하는 모델로서 가장 전형적이며 가장 많이 이용된다. 대표적인 특징은 아래 요약과 같다. 체중증가의 90% 정도는 체지방증가 에 의해서 결정되며 대사적으로 지방합성이 크게 증가하여 간에서의 지방함량은 대조군의 4배 이상에 달한다. Thermogenesis 이상은 빠르면 10일경부터 발견이 가능하고 지방세포는 약 2주 내에 크기가 증가하기 시작하며 고인슐린혈증은 4주 정도에 현저해진다. 렙틴의 결핍은 코티솔 농도를 증가시며 이 또한 근육에서의 인슐린저항성에 기여한다. 따라서 지방간 동물모델로서 이용되기도 하지만 NASH 모델로서는 적절하지 못하다는 주장도 있다. 이 모델의 또 하나의 특성은 체중이 최대에 도달한 이후부터는 혈당이 점차 감소하여 고령에서는 혈당과 고인슐린혈증이 다시 감소되어 혈당은 거의 정상화된다는 것이다 (4-6). db/db mice 염색체 4번에 있는 렙틴 수용체 유전자 (db gene)의 상염색체 열성 유전자 변이에 의해서 전형적인 특징이 나타나며 homozygote에서는 infertility가 발생한다. 특징적으로 C57BL/Ks background에서는 전형적인 비만증과 함께 결국 심한 당뇨병으로 사망하게 된다(4; 6). KK (Kuo Kondo) mouse 및 KK/Ay mouse Japanese KK mouse로 명명된 이 모델은 비만증과 제 2형 당뇨병의 Polygenic model로서 일본에서 큰 생쥐를 선택적으로 inbreeding하여 생겼으며 다식, 고인슐린혈증, 인슐린 저항성, 비만증 등이 2개월째에 까지는 나타나고 4-5개월째에 최고조에 달한다. 인슐린 저항성이 비만증보다 선행한다고 보고되었다(3). Yellow obese mice는 Agouti gene 의 변이에 의해서 hyperphagia, obesity, hyperinsulinemia, glucose intolerance를 특징으로 하는 모델이며 ob/ob mice에 비해서 덜 심한 편이다. Yellow skin pigmentation 정도와 비만과 관련성이 있다. Homozygote는 lethal 하기 때문에 heterozygote를 실험에 이용하며 이후에 viable Avy mice가 Jackson Laboratory에서 발견되었고 시판되고 있다. KK.Cg-Ay/J heterozygotes는 hyperglycemia, hyperinsulinemia, glucose intolerance, obesity를 8주 이내에 보이는데 Ay heterozygote와 Japanese KK mice 사이의 잡종으로 보면 된다 (7). New Zealand Obese (NZO) mouse 비만증 및 당뇨병 모델로서 agouti coat color를 기준으로 선택적으로 배양하여 발생하여 다음과 같은 특징을 가진다; hyperphagia, obesity, mild hyperglycaemia, hyperinsulinaemia, impaired glucose tolerance and insulin resistance. 체중은 첫 2개월 동안에 빠르게 증가하며 고혈당은 나이가 들수록 계속 진행하며 베타세포의 증식도 심하게 일어난다. 이 모델의 또 하나의 특징은 자가면역질환을 잘 동반한다는 것이다 (3). Zucker fatty rat 및 Zucker diabetic fatty rat Zucker (fa/fa) fatty or obese rat (Leprfa)은 5번 염색체에 있는 상염색체 열성 (fa) gene에 의해서 발생하는데 렙틴 유전자 신호에 결손 때문에 발생하는데 비만증, 제 2형 당뇨병, type IV hyperlipidaemia (increased VLDL and triglycerideLevels) 및 고혈압 등을 연구할 때 모델로 자주 사용된다. Zucker diabetic fatty rat은 베타세포의 보상기전의 한계 때문에 비만도는 Zucker (fa/fa) fatty rat 에 비해 덜하지만 고혈당이 더 심한 모델로 생각하면 될 것이다 (3). Obesity-induced diabetes in mouse strains treated with gold thioglucose Ventromedial hypothalamic nucleus (VMH)는 satiety center 로서 손상 시에 과식에 의한 비만증을 야기하는데 gold-thioglucose (GTG) (USP Catalog# 1045508)가 선택적으로 gold에 의한 신경독성을 야기하여 VMH 뉴우런을 선택적으로 파괴하는데 특히 GPR7 발현세포가 민감한 것으로 밝혀졌다 (8). GPR7은 neuropeptide B 및 neuropeptide W에 대한 G protein-coupled receptor로 알려졌다 (8). GPR7 mRNA 발현은 생쥐의 시상하부의 arcuate 및 VMH에 주로 발현이 있고 그 외 섭식조절, neuroendocrine pathways, 그리고 자율신경계의 기능조절에 관여하는 부위에도 발현되는 것으로 보고되었다 (8). Neuropeptide B 및 neuropeptide W는 식욕과 locomotor activity를 억제하고 아직 생리적 의의는 규명되지 않았지만 프로락틴 분비 증가 및 진통 효과도 보이는 것으로 밝혀졌다 (8; 9). GTG를 1회 복강 내 투여로 hyperphagia, 비만증, 체지방 증가, 고인슐린혈증, 렙틴증가, 인슐린 저항성, 고혈당 등의 제 2형 당뇨병에서 전형적으로 보이는 이상을 관찰할 수 있다. 다만 C57BL/6J mice 경우 혈당이 별로 증가하지 않는 경우도 있지만 이런 경우에도 고지방식사를 시키면 더 저명한 대사적 변화와 함께 고혈당도 현저해진다 (10). 비교적 쉬운 모델이 될 수 있지만 단점은 모든 mice에서 유발되는 되는 것이 아니라 mice strain에 따라서 약 50-80%에서만 비만증과 거식증이 성공적으로 유발된다 (11). 대신 일정 체중이 이상 차이가 나는 mice만 선별하여 정상 대조군과 비교실험을 할 수 있다. 또한 식후 혈당이 증가하는데 4주 이상이 걸리며 통상 8-12주 정도는 예상해야 한다 (11). 앞에서도 언급했듯이 이런 경우 고지방 식사 모델과 병합하여 이용하는 것이 유리할 것이다. GPR7-/- mice 실험에서도 비슷한 결과들이 재현되었으며 GPR7-/- mice 의 경우 특별환 해부학적 이상이 없이 태어나서 생식력이 있으며 수컷 생쥐에서만 전형적인 비만증과 지방간 소견을 보이는 것으로 보고되었다 (8). 대사적 이상 소견으로서는 hyperphagia, energy expenditure의 감소, locomotor activity의 감소를 보였다. 고지방 식사 동물 모델 동물모델 특히 쥐나 생쥐에서 지방섭취량과 체중증가 및 체지방량은 비례하며 통상적으로 총칼로리 섭취량의 30% 이상을 지방이 차지하면 고지방식사로 여기며 보고자 마다 다양한 식이를 섭취시킨다(30-78%) (12; 13). 또한 지방산의 포화도도 다르며 지방식이에 같이 포함된 macronutrients 및 micronutrients의 함량도 다른 경우가 있기 때문에 문헌을 고찰하거나 실험을 계획할 때 유념하여 고지방식사의 형태를 정해야 할 것으로 보인다. 인간에서 주로 사용하는 BMI나 기타 여러 방법과 비슷한 비만도를 평가하는 기준이 없기 때문에 통상적으로 대조군과 비교하는데 대조군은 일반 사료 혹은 저지방 사료를 먹인 쥐나 생쥐이다. 대조군에 비해서 체중이 10-25% 정도 높으면 중등도 비만증, 40%를 초과하면 고도 비만증으로 정의하기도 한다. 고지방 식사를 시키면 C57BL/6J mice 경우 통상 1주에 1g 정도 증가하는데 2주 정도면 체중이 대조군에 비해 높은 경향을 보이면서 4주정도면 유의하게 높다. 고지방식사에 의해서 체중이 증가되는 가장 큰 이유는 diet-induced thermogenesis가 지방섭취 시에 가장 적기 때문이다. 즉 지방섭취 시에 소화, 흡수, 저장에 에너지가 가장 적게 소모된다 (지방, 2-3%; 단백질, 25-30%; 탄수화물 6-8%). 따라서 지방은 에너지 효율이 97-98%로서 매우 높지만 반면에 단백질은 70-75% 정도이며 탄수화물은 중간에 속한다 (30-78%)(12; 13). 또한 탄수화물에 비해서 지방식이는 포만감을 덜 느끼게 하는 것으로 동물실험에서 나타났다. 흥미롭게도 내당능장애의 정도와 고지방식이의 지방함량과 비례한다는 보고도 있다(12; 13). 특히 인슐린 저항성에 관련된 기전들의 이상은 총 에너지 40% 이상의 고지방식사를 시킬 때 저 저명하다. 또한 포화지방과 불포화지방산 함량에 따라서 인슐린 감수성이나 인슐린 분비도 영향을 받는데 불포화지방산은 포화지방산에 비해서 인슐린 감수성과 분비를 개선시킨다는 보고가 있으며 이 역시 일관되게 관찰되는 것은 아니며 렙틴이나 ghreline 분비 등에 있어서도 보고자 마다 다르게 보고하고 있어서 동물실험 시에는 이에 대한 고려도 필요하다. 고지방 식사를 시킬 때 특히 outbred rats or mice의 경우 obesity-prone or obesity-resistant group으로 나누어서 분석하는 경우도 있으며 대조군이 있는 경우는 고지방 식사군에서도 일부 실험동물에서는 체중중가가 예상보다 적은 경우가 있을 수 있음을 고려하여 동물 구입시부터 충분한 실험동물 수가 확보되도록 해야 한다. 통상적으로 암컷에 비해 수컷 쥐나 생쥐가 더 선호된다. 이는 암컷의 경우 매 4-6일마다 oestrous cycle 이 반복되기 때문이다. 혈당, 인슐린, 유리지방산, 중성지방과 같은 대사적 변수들을 비교 분석할 때는 animal fat 혹은 plant oil을 수주간 섭취시키면 대개는 경도의 고혈당이 생기지만 fish oil 함량이 높은 경우는 고혈당이나 인슐린 저항성 발생이 덜 발생한다. 이러한 차이가 현저하여 매 실험이나 보고자 마다 일관된 것은 아니고 고혈당이 발생하지 않는 경우도 자주 볼 수 있으므로 이에 대한 고려도 필요하다. 인슐린 저항성은 2-6주 사이에 발생하지만 고혈당은 훨씬 이후에 발생하여 당뇨병 수준까지는 도달하기 어렵거나 wistar rat의 경우 12개월까지 고지방식사를 시켜야 한다는 보고가 있어서 당뇨병 모델로서는 부적합한 모델이다. 중성지방도 고혈당과 비슷한 패턴을 보이며 콜레스테롤은 일관되게 증가되는 경우는 없다. Wistar 및 SD rats 그리고 C57BL/6 mice가 가장 많이 이용된다 (14). 추가적으로 분자생물학적 연구를 할 때는 간, 근육, 지방 조직 모두가 똑 같은 결과가 나오지 않을 수도 있으며 특히 insulin signaling은 근육조직에서는 비교적 일관되게 장애가 있는 것으로 나오지만 특히 간조직에서는 변화가 없게 나오는 경우도 흔하며 고지방식사의 기간, 지방함량, 불포화 지방산 함유정도, insulin signaling 실험 시에 조건 등에 따라서 보고자 마다 결과가 달라 결론을 내리기 어려운 경우도 흔하므로 한가지 조직만 시행할 것이 아니라 두 조직 이상을 평가하는 것이 좋을 것 같다 (1). 고지방식사에 의한 대부분의 조직을 포함하여 전형적인 이상들이 모두 나타나려면 최소 16주 이상 고지방 식사를 시키는 것이 좋다(1). 최근에는 고지방식사 동물모델에서 신질환의 진행에 있어서 AMPK활성 억제가 작용한다는 것이 보고되었으며 심혈관계 처럼 빠르게 신장에서의 병태생리적 변화가 보고되었다(15). 이 보고에서는 고지방식사 12주째에 fibrosis 관련 유전자들의 발현이 현저하게 신장에서 증가하는 것이 확인 되었다(15). 아직도 고지방 식사 동물모델은 더 밝혀야 할 분야가 많고 비교적 쉽게 적은 비용으로 실험할 수 있다는 장점이 있지만 고혈당은 저명하지 않아서 이와 관련된 연구에서는 적절한 모델은 아니다. Fructose-fed rats 사람에서는 fructose만 과다하게 섭취하기가 어렵지만 동물모델에서는 high fructose diet 모델이 연구 목적에 따라서 대사증후군을 연구하는 좋은 모델이 될 수 있다. 특히 간에서 de novo lipogenesis 및 지방간, 고지혈증 및 유리지방산 증가, 피하지방에 비해 상대적으로 복부지방 증가, 인슐린 저항성, 그리고, 고혈압 등이 동반된 모델로서 고지방 식사 동물과는 다른 특징을 보인다(16; 17). 최근에는 장에서의 세균총의 변화와 혈중 lipopoysaccaride의 증가 및 Toll-like recetor-4 signaling의 증가가 지방간을 증가시키는 새로운 기전으로 보고되면서 이와 관련된 연구에서도 좋은 모델이 될 것으로 보인다. 이 모델에서는 복부지방은 저명하게 증가되지만 체중은 대조군에 비해 크게 증가하지는 않는다(16). 지방간 (Nonalcoholic fatty liver disease; NAFLD)모델 최근 지방간에 대한 연구가 활발해지고 관심이 늘고 있지만 동물모델에 대한 충분한 검토가 필요하다 (18). 특히 단순 steatosis, Nonalcoholic steatohepatitis (NASH) 단계를 거쳐서 간경변증이나 간암까지 진행할 수 있기 때문에 서구의 경우 과체중 인구가 거의 60%에 달한다는 것을 감안하면 잠재적 위험은 매우 크다고 할 수 있다. 실제 서구에서는 향후 간암의 약 1/3은 NAFLD가 원인일 것이라는 예측이 가능하다 (18). 따라서 동물모델을 이용한 연구가 많이 있지만 모델 자체가 아직 완전한 모델이 없다. 과잉영양 상태에 의해서 NAFLD가 발생하지만 실제 흔하게 사용하는 모델 중의 하나인 methionine and choline deficient (MCD) diet는 40% sucrose, 10% 지방이 함유된 식이이지만 베타-산화와 VLDL합성에 중요한 역할을 하는 methionine 및 choline 이 없기 때문에 지방간을 일으킨다. MCD 식이에 의한 지방간 모델은 체중 및 체지방이 감소하고 혈중 중성지방과 콜레스테롤은 감소하기 때문에 실제 임상에서 흔한 비만증과 같은 표현형은 아니며 전신 인슐린저항성과는 관련이 없다 (18). 고지방식사 동물모델은 steatosis는 현저하게 나타나지만 섬유화의 경우는 지방식과 모델에 따라서 거의 50주 가까이 기다려야 섬유화 나타나는 경우가 있으므로 모델 선택 시 고려할 사항이 많다. 이를 극복하기 위해 위장관 튜브를 이용하여 과영양을 시키거나 지방조성을 달리하는 방법들이 사용되고 있지만 아직 여러 연구자들의 실험을 통하여 재확인 데이터가 부족하다는 단점이 있다. 고지방 식사에 의한 지방간의 발생은 생쥐 (mice)보다는 쥐 (rat)에서 더 현저하고 또한 인간에서의 병적 소견과 더 유사하다 (18). 또한 연구자들이 저명한 비만증과 당뇨병 모델로서 많이 사용하는 ob/ob mice역시 steatosis는 현저하지만 섬유화는 나타나지 않는다 (19). 아래 표에 각 모델의 특성을 요약하였다(20). 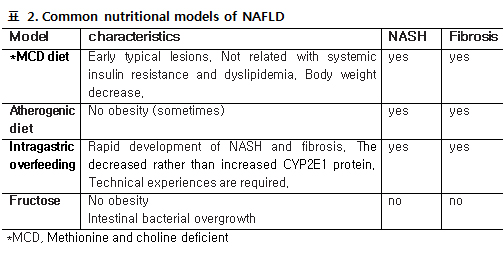 최근에는 gold thioglucose를 투여한 hyperphagia 생쥐 모델에서 고지방 식이를 투여하여 대사적 이상 (obesity with increased abdominal adiposity, glucose intolerance and insulin resistance)이 조기에 저명해지고 인간에서의 NASH와 거의 유사한 병리학적 소견(marked steatohepatitis with lobular inflammation, hepatocyte ballooning and Mallory-Denk bodies)이 이미 12주에 저명하게 나타나는 것으로 보고되었다 (10). 이 모델에 대한 데이터가 축적되면 적절한 모델이 될 것이라고 여겨진다. 결 론 당뇨병과 비만에서의 동물모델을 이용한 실험은 monogenic mice 모델이나 transgenic mice 모델의 경우 비용 때문에 쉽게 행할 수 없는 상황이지만 연구목적에 꼭 필요한 경우는 미리 계획하여 적절한 모델을 선택하여 적절한 시기에 하는 것이 중요하고 연구경험과 주변 여건이 허락할 때까지는 high fat diet gold thioglucose 모델을 이용한 연구도 좋은 대안이 될 것으로 여겨진다. References
|